【醫藥新知】新型C型肝炎藥物 有使B型肝炎復發的風險
美國食品藥品監督管理局(Food and Drug Administration)針對C型肝炎DAAs藥物發出警訊,
要求廠商應以最嚴重的黑框警告等級(black-box warning),
標明該種藥物將有引起B型肝炎病毒再活化之風險。
編譯/莊宇真(《艾美的閒話健康》部落格drugandpoison.blogspot.tw)
C型肝炎是較晚近、約三十年前才發現的肝炎病毒,當時主要是觀察到許多輸血後的急性肝炎反應,但並非已知的A、B型肝炎。C型肝炎病毒,主要經由血液進入體內傳染,常見於使用滅菌不完全之器械(具)、污染針具、或接受污染之血液、血液製劑等。一九九二年,台灣捐血中心將C型肝炎病毒抗體檢驗,列入常規篩檢項目,大幅降低了輸血後非A、B型肝炎的發生率。
C型肝炎病毒目前主要有六種基因型,以台灣而言,最常見的是基因型1(1b ,四六~七七%)、基因型2(2a/2c,三一~六五%)(註一)。傳統治療以干擾素(INF)搭配一般抗病毒藥物雷巴威林(ribavirin),副作用較大,且對於基因型1的病人治癒率不到一半,而基因型1較容易造成潛伏傳染,造成的肝病也較嚴重,有較高機率演變為肝癌(註二)。
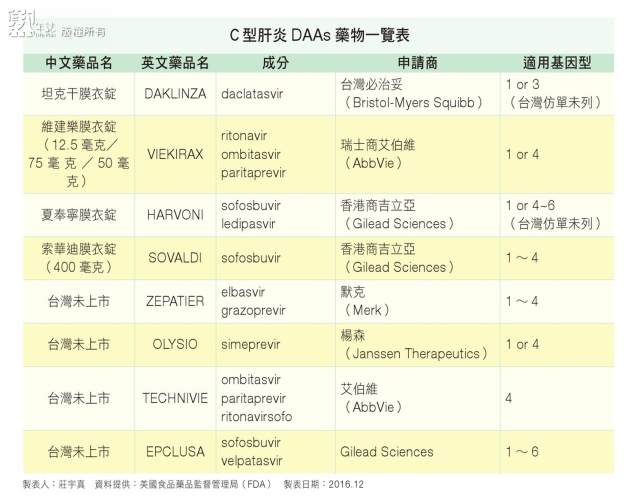 台灣C型肝炎盛行率約四%,根據報載,國健署統計目前約有七十五萬人罹患C型肝炎,與鄰近的日本(○‧四九%)、南韓(一.三%)相較之下高出很多(註三)。近幾年,國外各大藥廠針對病毒,研發出多種口服小分子直接抗病毒藥物(direct antiviral agents, DAAs),提高對基因型1病人的治癒率,副作用也大幅減輕(註四、註五)。面對這些有效治療C型肝炎的新藥物上市,健保主管機關也在配合國家根除肝病的政策下,預計於今年(二○一七年)將C型肝炎DAAs藥物,納入健保給付中(註六)。
台灣C型肝炎盛行率約四%,根據報載,國健署統計目前約有七十五萬人罹患C型肝炎,與鄰近的日本(○‧四九%)、南韓(一.三%)相較之下高出很多(註三)。近幾年,國外各大藥廠針對病毒,研發出多種口服小分子直接抗病毒藥物(direct antiviral agents, DAAs),提高對基因型1病人的治癒率,副作用也大幅減輕(註四、註五)。面對這些有效治療C型肝炎的新藥物上市,健保主管機關也在配合國家根除肝病的政策下,預計於今年(二○一七年)將C型肝炎DAAs藥物,納入健保給付中(註六)。
去年(二○一六年)十月四日,美國食品藥品監督管理局(Food and Drug Administration)針對C型肝炎DAAs藥物發出警訊(註七),根據二○一三年至二○一六年間,向美國食品藥品監督管理局通報,與發表於期刊的二十四個案例中發現,使用DAAs藥物治療四~八週後,曾經感染過B型肝炎,或正感染B型肝炎病毒的病人,會因此產生B型肝炎病毒再活化(reactivation)。在這些案例裡,有二人死亡,一人需要進行肝臟移植(註八)。
因此,美國食品藥品監督管理局對DAAs藥物,要求廠商應以最嚴重的黑框警告等級(black-box warning),將有引起B型肝炎病毒再活化之風險,以黑框註明於商品包裝與使用說明(仿單)中。
在台灣,每四個人中,約有一個人可能是B型肝炎病毒帶原者;因此,面對即將納入健保給付的C型肝炎新藥治療,醫師與病人都不可輕忽這項警訊。
面對以C型肝炎DAAs藥物的治療方案,醫師應先給予相關檢驗,確認病人是否為B型肝炎病毒帶原者,或有其他肝臟問題;而身為病人,也應盡可能詳細地跟醫師說明自己的病史,包括是否曾感染過B型肝炎,以及其他肝臟方面的問題。
在治療的過程中,醫師必須定期驗血,來監測是否有B型肝炎發作的傾向,並應持續追蹤至療程完成的幾個月之後。
若您正在接受C型肝炎口服DAAs藥物治療,一旦察覺到有異常的虛弱、無力、失去胃口、噁心、嘔吐、眼睛或皮膚泛黃、排出淺色糞便等症狀,請立即跟您的主治醫師聯繫,因為這些很可能是嚴重肝臟問題的徵兆。
註一:謝佩真、郭行道、卓文春、廖永樑、林靖南,〈C型肝炎病毒基因分型及其臨床重要性〉,《內科學誌》,二十期,三○九~三一九頁,二○○九年。
註二:Chen-Hua Liu, Jia-Horng Kao. Nanomedicines in the treatment of hepatitis C virus infection in Asian patients: optimizing use of peginterferon alfa. Int J Nanomedicine. 2014; 9:2051-2067.
註三:台大醫院基因醫學部,慢性C型肝炎。
註四:沈柏榕、劉秀真、陳怡樺、陳玉瑩,〈簡介C型肝炎藥品的新發展〉,《長庚藥學學報季刊》,二十二卷三期,一~九頁,二○一五年。
註五:台大醫院小兒部,陳思達、張美惠,〈除了排鐵治療別忘了C型肝炎的治療〉。
註六:自由時報,〈「C肝新藥」納健保十月拍板〉,二○一六年八月十九日。
註七:Worst Pills, Best Pills. Food and Drug Administration Warns of Hepatitis B Reactivation With Hepatitis C Drugs. October 7, 2016.
註八:FDAD rug Safety Communication: FDA warns about the risk of hepatitis B reactivating in some patients treated with direct-acting antivirals for hepatitis C. October 4, 2016.
